BioximiaForYou
Общая характеристика белков и аминокислот
Химия белков: Общая характеристика белков и аминокислот.
Общая характеристика и биологическое значение белков.
Белки являются наиболее важными и сложными органическими соединениями, входящими в состав живых организмов. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков.
В количественном соотношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. Так, в организме человека белки составляют 40-50% из расчета на сухую массу.
Каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
Белки – это высокомолекулярные соединения, построенные из аминокислот. В создание белков участвует 20 аминокислот. Они связываются между собой в длинные цепи, которые образуют основу белковой молекулы большой молекулярной массы.
Белки выполняют важные функции в организме:
Ø Каталитическая – практически все химические реакции, протекающие в животной клетке, катализируются специфическими веществами, называемыми ферментами. По химической природе все ферменты являются белками.
Ø Структурная – белки составляют 1/5 част, или 20% массы тела. Коллаген – структурный белок соединительной ткани.
Ø Энергетическая – при полном распаде 1 г белка выделяется 17,15 кДж (4,1 ккал) энергии, что указывает на их способность участвовать в обеспечении организма энергией. Однако использование белков для этих целей происходит только в том случае, когда отмечается недостаток основных источников энергии – углеводов и жиров.
Ø Транспортная – определенная группа белков крови обладает способностью взаимодействовать с различными соединениями и переносить их. Так транспортируются в организме нерастворимые в воде вещества (ионы, металлы, газы) или токсические продукты (билирубин, жирные кислоты и др.). Примером транспортных белков могут служить гемоглобин (переносящий кислород и углекислый газ), трансферрин (белок транспортирующий железо), липопротеиды – сложные белки транспортирующие липиды.
Ø Защитная – в процессе эволюции выработались механизмы узнавания и связывания «чужих» молекул с помощью специфических белков (антител).
Ø Регуляторная – определенные белки являются гормонами, участвуют в регуляции разнообразных процессов, протекающих в организме. Белки участвуют в регуляции важных констант крови: создают онкотическое давление крови; входят в состав буферных систем, влияют на кислотно-основное равновесие крови.
Ø Участие белков в процессах наследственности, т.е. хранении и передачи генетической информации. Эта функции выполняется сложными белками – нуклеопротеидами.
Ø Сократительная – важным признаком живого является подвижность. В основе ее лежит сократительная функция белков.
Ø Гемостатическая функция – белки участвуют в образовании тромба и предотвращении кровотечения.
Химический состав белков.
Белки являются сложными соединениями, полимерами, которые состоят из простых, низкомолекулярных веществ – мономеров.
Химический анализ показал наличие во всех белках углерода, кислорода, водорода, азота и серы, содержание которых следующее: углерода – 50-55%, водорода – 6-7%, кислорода – 21-23%, азота – 15-17%, серы – 0,3-2,5%. В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы в различных, часто очень маленьких количествах.
Содержание основных химических элементов в отдельных белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством и в среднем составляет 16%.
Исходными составными частями белков являются аминокислоты, которые определяют физико-химические и биологические свойства белков.
Аминокислоты – это аминопроизводные класса карбоновых кислот.
Аминокислоты живых организмов можно разделить на протеиногенные (кодируются генетическим кодом) и непротеиногенные (не кодируются генетическим кодом). Протеиногенных аминокислот 20; 19 из них являются α-аминокислотами, что означает, что атом водорода α-углеродного атома замещен на аминогруппу (NH2). Общая формула этих аминокислот выглядит следующим образом:
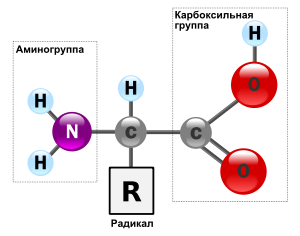
Только одна аминокислота – пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
α-углеродный атом аминокислот является асимметричным (исключение составляет аминопроизводное уксусной кислоты — глицин). У каждой аминокислоты имеются как минимум два оптически активных антипода. Природа выбрала для создания белков L-форму, поэтому природные белки построены из L-α-аминокислот.
Для классификации аминокислот пользуются физико-химическими свойствами их радикалов. Существуют разные подходы к такой классификации.
Большая часть аминокислот – это алифатические соединения, две аминокислоты принадлежат к ароматическому ряду и две – к гетероциклическому.
Аминокислоты можно разделить по их свойствами на основные, нейтральные и кислые.
Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные содержат по одной амино- и одной карбоксильной группе. Кислые имеют две карбоксильные и одну аминогруппу, основные — две аминогруппы и одну карбоксильную.
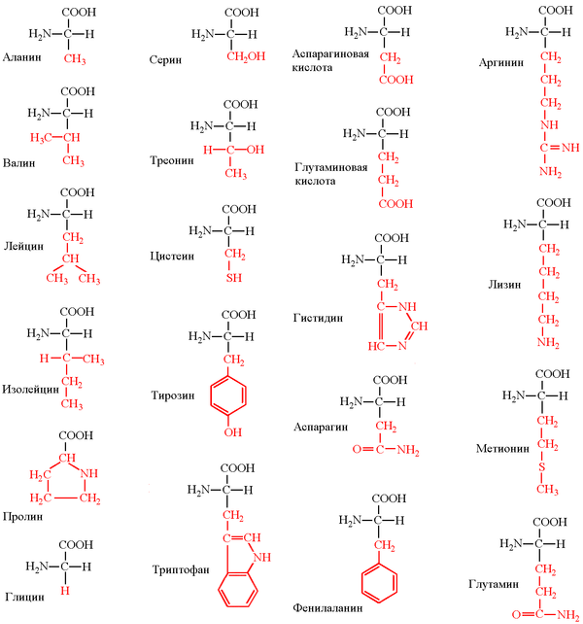
Пользуясь таким свойством аминокислот, как полярность, можно разделить их на группу неполярных (гидрофобных) аминокислот (аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан), группу полярных (гидрофильных) незаряженных аминокислот (глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин), группу отрицательно заряженных (кислых) аминокислот (аспарагиновая и глутаминовая кислоты) и группу положительно заряженных (основных) аминокислот (аргинин и лизин).
По способности человека синтезировать их из предшественников
Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин.
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Некоторые заменимые аминокислоты синтезируются в организме человека в недостаточных количествах и должны поступать с пищей.
Характеристика аминокислот
Собственно алифатическими можно назвать 5 аминокислот.
Глицин (Гли), или гликокол (аминоуксусная кислота), является единственной оптически неактивной аминокислотой из-за отсутствия ассиметрического углеродного атома. Глицин участвует в синтезе белка, образовании нуклеиновых и желчных кислот (его атомы входят в состав нуклеотидов, гема и в состав важного трипептида глутатиона), а также необходим для обезвреживания в печени токсических продуктов.
Аланин (Ала) (аминопропионовая кислота) нередко используется организмом для синтеза глюкозы.
Валин (Вал) — аминоизовалериановая кислота, лейцин (Лей) — аминоизокапроновая кислота, изолейцин (Иле) — α-амино-β-этил-β-метилпропионовая кислота, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы. Активно участвуют в обмене веществ.
Гидроксиаминокислоты:
Серин (Сер) — α-амино-β-гидроксипропионовая кислота и Треонин (Тре) — α-амино-β-гидроксимасляная кислота — играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков. Серин входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков. Треонин участвует в биосинтезе белка.
Серосодержащие аминокислоты.
Цистеин (Цис) — α-амино-β-тиопропионовая кислота, благодаря активной —SH-группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков. Две молекулы цистеина, окисляясь, образуют цистин. При этом образуется дисульфидная связь.
Метионин (Мет) — α-амино-β-тиометилмасляная кислота — выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т. д.
Дикарбоновые аминокислоты:
Глутаминовая (Глу) — α-аминоглутаровая кислота и Аспарагиновая (Асп) — α-аминоянтарная кислота — наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Они участвуют в биосинтезе белка, образовании важнейших соединений (тормозных медиаторов нервной системы, других аминокислот), энергетическом обмене. Эти аминокислоты могут образовывать амиды.
- Амиды дикарбоновых аминокислот: глутамин (Гли) и аспарагин (Асн) — выполняют важную функцию в обезвреживании и транспорте аммиака в организме.
Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро.
Фенилаланин (Фен) —α-амино-β-фенилпропионовая кислота и Тирозин (Тир) — α-амино-β-параоксифенилпропионовая кислота — эти две аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, например участие их в синтезе ряда биологически активных веществ (адреналин, тироксин). Фенилаланин служит основным источником синтеза тирозина, являющегося предшественником ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов.
Триптофан (Три) — α-амино-β-индолилпропионовая кислота используется для синтеза витамина РР, серотонина, гормонов эпифиза.
Гистидин (Гис) — α-амино-β-имидазолилпропионовая кислота может использоваться при образовании гистамина, регулирующего проницаемость капилляров и проявляющего свое действие при аллергии.
Диаминомонокарбоновые аминокислоты:
Лизин (Лиз) — диаминокапроновая кислота и Аргинин (Apг) — α-амино-β-гуанидинвалериановая кислота — имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Лизин необходим для синтеза белков, в том числе гистонов, входящих в состав нуклеопротеидов; обнаружен в структуре некоторых ферментов. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
Иминокислота — Пролин (Про) отличается от других аминокислот по строению. Особое место отводится этой аминокислоте в структуре коллагена, где пролин в процессе синтеза коллагена может превращаться в гидроксипролин.
Вход на сайт |
|---|
Поиск |
|---|
Календарь | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||
Статистика |
|---|
Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
Друзья сайта |
|---|
