Строение, свойства, классификация аминокислот
Структура белков
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
Первичная структура. Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Пептидная связь образуется за счет α-карбоксильной группы одной аминокислоты и α-аминной группы другой.
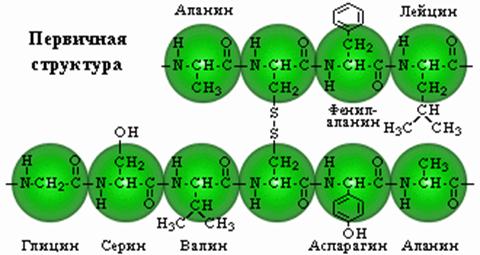
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид; если к нему добавить еще одну, то возникнет трипептид и т.д. Пептиды, содержащие до 10 аминокислот, называют олигопептидами, а до 50 — полипептидами. Полипептиды, содержащие более 50 аминокислот, уже называют белками, хотя это название чаще используют для соединений, содержащих более 100 аминокислот.
Аминокислотные звенья, входящие в состав пептида, обычно называют аминокислотными остатками. Они уже не являются аминокислотами, так как в результате образования пептидных связей у каждой из них не хватает одного атома водорода в аминной группе и одного гидроксильного аниона в карбоксильной. Аминокислотный остаток, находящийся на том конце пептида, где имеется свободная α-аминная группа, называется аминоконцевым или N-концевым остатком; остаток же на противоположном конце молекулы, имеющем свободную карбоксильную группу,— карбоксиконцевым или С-концевым. Название пептидов образуется из названия входящих в них аминокислотных остатков в соответствии с их последовательностью, начиная с N-конца.
Вторичная структура. Представляет собой упорядоченную и компактную упаковку полипептидной цепи. По конфигурации она бывает в виде спирали и складчатой структуры.
Основу α-спирали составляет пептидная цепь, а радикалы аминокислот направлены кнаружи, располагаясь по спирали. Внешне α-спираль похожа на слегка растянутую спираль электроплитки. Такая форма характерна для белков, имеющих одну полипептидную цепь (альбуминов, глобулинов и др.).
Складчатая β-структура представляет собой плоскую форму и похожа на меха гармошки. Она характерна для белков, имеющих несколько полипептидных цепей, расположенных параллельно, β-структура встречается в таких белках, как трипсин, рибонуклеаза, кератин волос, коллаген сухожилий.
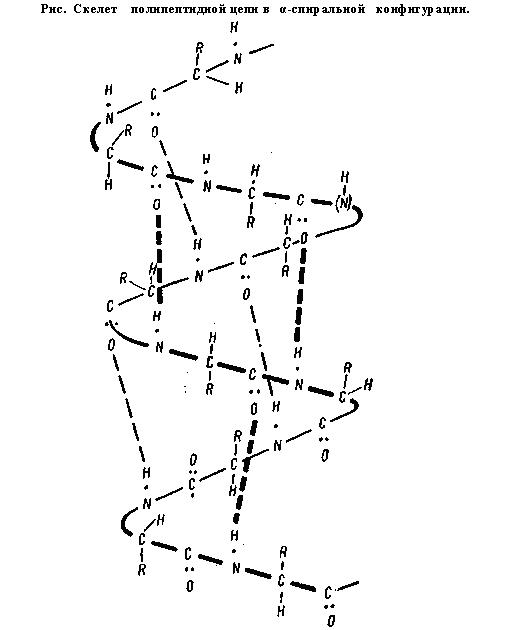
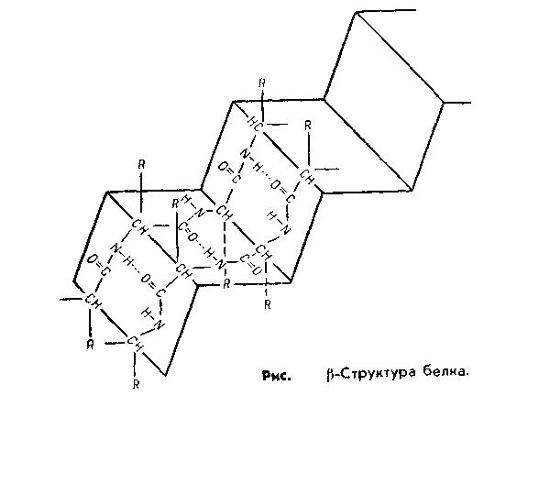
Образование вторичной структуры обеспечивается водородной связью. Она образуется при участии атома водорода, находящегося между двумя сильноотрицательными атомами, к одному из которых он (водород) имеет большее сродство.
Водородная связь является слабой, она легко образуется и так же легко разрывается. В молекуле белка этот вид связи образуется между водородом α-аминной группы одной пептидной связи и кислородом β-карбоксильной группы другой.
В α-спирали водородная связь образуется таким образом, что каждая NH-группа пептидной связи соединяется с четвертой по счету вдоль цепи СО-группой другой связи. Именно благодаря такому соединению обеспечивается спирализация цепи. В β-структуре водородная связь образуется между теми же группировками, но принадлежащими разным полипептидным цепям. Таким образом, все СО- и NH-группы полипептидных цепей оказываются связанными между собой водородными связями.
Третичная структура. Имеющая третичную структуру белковая молекула представляет собой более компактное пространственное расположение полипептидной цепи, точнее ее вторичной структуры. Форма третичной структуры может быть самая различная и определяется тем, что различные функциональные группы полипептидной цепи могут образовывать различные типы связей (электростатические, ионные, силы Ван-дер-Ваальса и др.).
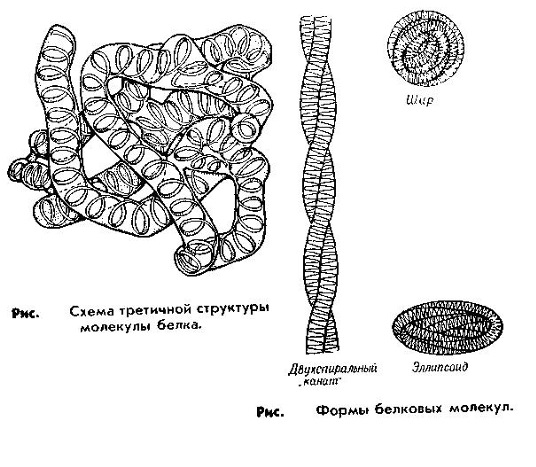
Этот тип структуры является довольно жестким, что обусловлено наличием дисульфидных (—S...S—) связей (дисульфидных мостиков), которые образуются между атомами серы двух молекул цистеина, расположенных в разных участках полипептидной цепи.
Именно третичная структура обеспечивает выполнение белком его основных функций и в зависимости от этого третичная структура может быть представлена или в виде шарика (глобулы) у глобулярных белков, или и виде нитей (фибрилл) у фибриллярных белков. Глобулярные белки обнаружены в крови и многих органах. Их представителями являются альбумины и глобулины. Фибриллярные белки составляют основу мышечной ткани.
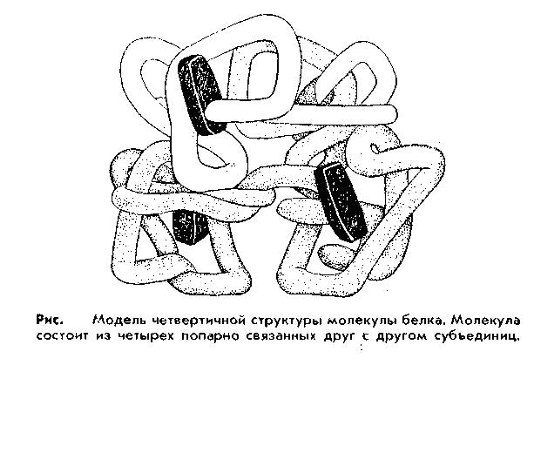
Четвертичная структура. В организме имеются более сложные по структуре белки, состоящие из нескольких так называемых субъединиц, каждая из которых представляет собой молекулу белка со своей специфической структурой, вплоть до третичной. Такое объединение субъединиц называют четвертичной структурой. Особенностью белков с четвертичной структурой является их способность проявлять свои функции и свойства только при наличии всех субъединиц. Удаление хотя бы одной из них приводит к потере функций. К таким белкам относятся гемоглобин, ряд ферментов и др.
Т.о., под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой.
Свойства белков
Белки имеют высокую молекулярную массу, растворимы в воде, способны к набуханию, характеризуются химической активностью, подвижностью в электрическом поле и некоторыми другими свойствами. Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуются пептидная, водородная, дисульфидная и другие виды связей. К радикалам аминокислот, а, следовательно, и белков, могут присоединяться различные соединения и ионы, что обеспечивает транспорт их по крови.
1. Белки являются высокомолекулярными соединениями. Это полимеры, состоящие из многих сотен и тысяч мономеров — аминокислот. Соответственно и молекулярная масса белков находится в пределах 10000— 1000000. Так, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка и ее молекулярная масса составляет примерно 14000. Миоглобин (белок мышц), состоящий из 153 остатков аминокислот, имеет молекулярную массу 17000, а гемоглобин — 64500 (574 аминокислотных остатка). Молекулярные массы других белков более высокие: γ_глобулин (образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150000, а молекулярная масса фермента глутаматдегидрогеназы превышает 1000000.
Определение молекулярной массы проводится различными методами: осмометрическим, гельфильтрационным, оптическим и др. Однако наиболее точным является метод седиментации, предложенный Т. Сведбергом. Он основан на том, что при ультрацентрифугировании с ускорением до 900000 g скорость осаждения белков зависит от их молекулярной массы.
2. Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, т. е. выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот.
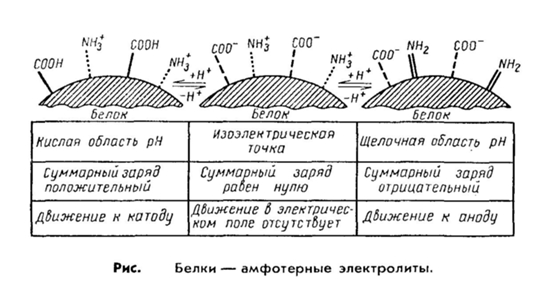
Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Эти же группировки имеют и электрические заряды, которые формируют общий заряд белковой молекулы. В белках, где преобладают аспарагиновая и глутаминовая аминокислоты, заряд белка будет отрицательным, избыток основных аминокислот придает положительный заряд белковой молекуле. Вследствие этого в электрическом поле белки будут передвигаться к катоду или аноду в зависимости от величины их общего заряда. Так, в щелочной среде (рН 7 - 14) белок отдает протон и заряжается отрицательно, тогда как в кислой среде (рН 1 - 7) подавляется диссоциация кислотных групп и белок становится катионом.
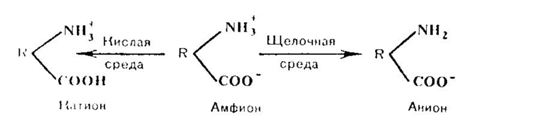
Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако при определенных значениях рН число положительных и отрицательных зарядов уравнивается, и молекула становится электронейтральной, т. е. она не будет перемещаться в электрическом поле. Такое значение рН среды определяется как изоэлектрическая точка белков. При этом белок находится в наименее устойчивом состоянии и при незначительных изменениях рН в кислую или щелочную сторону легко выпадает в осадок. Для большинства природных белков изоэлектрическая точка находится в слабокислой среде (рН 4,8 — 5,4), что свидетельствует о преобладании в их составе дикарбоповых кислот.
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови. Амфотерность белков используют для разделения их на фракции, например методом электрофореза, с целью диагностики ряда заболеваний и контроля за состоянием больного, так как при различных патологических состояниях фракционный состав белков существенно меняется.
3. Важное значение для организма имеет способность белков адсорбировать на своей поверхности некоторые вещества и ионы (гормоны, витамины, железо, медь и др.), которые либо плохо растворимы в воде, либо являются токсичными (билирубин, свободные жирные кислоты). Белки транспортируют их по крови к местам дальнейших превращений или обезвреживания.
4. Водные растворы белков имеют свои особенности. Во-первых, белки обладают большим сродством к воде, т. е. они гидрофильны. Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок.
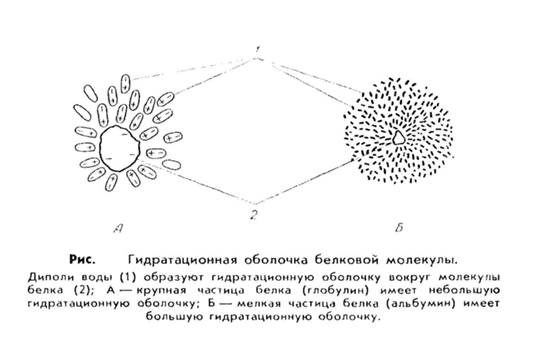
Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже и гидратная оболочка у них меньше.
Таким образом, устойчивость водного раствора белка определяется двумя факторами: наличием электрического заряда белковой молекулы и находящейся вокруг нее гидратной оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Обратимое осаждение белков (высалившие) предполагает выпадение белка в осадок под действием определенных веществ, после удаления, которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной гидратной оболочки белковых молекул и концентрацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую гидратную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой,- при полном насыщении.
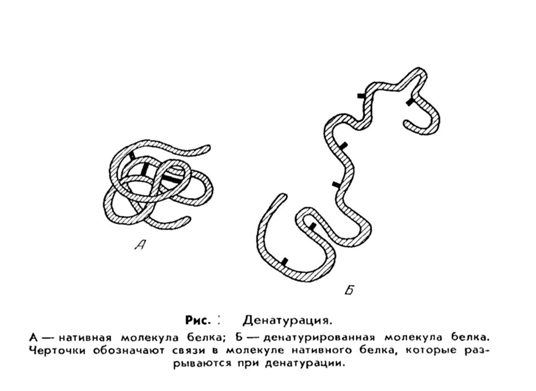
Необратимое осаждение связано с глубокими внутримолекулярными изменениями структуры белка, что приводит к потере ими нативных свойств (растворимости, биологической активности и др.). Такой белок называется денатурированным, а процесс - денатурацией.
Денатурация белков (от лат. de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка кислотой приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Денатурация белков происходит в желудке, где имеется сильно кислая среда (рН 0,5 - 1,5), и это способствует расщеплению белков протеолетическими ферментами.
Денатурация белков положена в основу лечения отравлений тяжелыми металлами, когда больному вводят per os молоко или сырые яйца с тем, чтобы металлы, денатурируя белки молока и яиц, адсорбировались на их поверхности и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима.
5. Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоидными частиц… Продолжение »
